1. Đặc điểm, tính chất nano Fe0
Kích thước nhỏ bé của hạt nano giúp nó phân tán mạnh trong môi trường dưới bề mặt. Trong khi đó do có diện tích bề mặt riêng lớn nên nó có khả năng phản ứng nhanh với các chất ô nhiễm (Heesu Park, Yong-Min Park, Kyoung-Min Yoo and Sang-Hyup Lee, 2009).
    |
 |
| Hình 1. Sản phẩm nano Fe(0) thu được trước và sau khi sấy khô |
Hiện nay, các ứng dụng của nano Fe
0 chủ yếu dựa trên đặc tính đóng góp điện tử trong phản ứng khử của nano Fe
0. Trong điều kiện môi trường bình thường, nano Fe
0 phản ứng tốt trong nước và có thể đóng vai trò là một chất cho điện tử, giúp nó trở thành một vật liệu có khả năng xử lý ô nhiễm tốt.
Cấu trúc lõi - vỏ
Phần lõi bao gồm chủ yếu là Fe0 nano và cung cấp năng lượng khử cho
các phản ứng với chất gây ô nhiễm môi trường.
Phần vỏ này phần lớn là các ôxit sắt/hydroxit được hình thành từ sự ôxi hóa Fe0. Lớp vỏ này là nơi cung cấp những thông tin hóa học phức tạp (ví dụ: sự hấp phụ hóa học). Các nhà nghiên cứu đã phủ một lớp mỏng chứa oxit hoặc kim loại quý lên bề mặt phân tử nano để tránh sự ôxi hóa sắt (Chul C.H., Mohammad A.B., Raj S., 2008)
    |
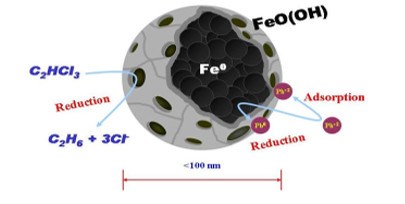 |
| Hình 2. Cấu trúc lõi vỏ của hạt nano Fe0 |
Sự hình thành lớp vỏ oxit bao quanh phân tử sắt nano đầu tiên là sự tạo thành Fe2+ trên bề mặt :
Ở pH thấp (≤ 8) lớp sắt ôxit có khả năng là vật mang và hút chủ yếu các anion như phốt pho, sunfat, nhưng khi ở pH đạt tới điểm đẳng điện, bề mặt oxit không là vật mang và nó có thể hình thành phức giữa bề mặt với cation (ví dụ các ion kim loại).
Diện tích bề mặt riêng
Cùng với kích thước vật liệu, cấu trúc lõi - vỏ, kết cấu và diện tích bề mặt riêng cũng là một yếu tố quan trọng ảnh hưởng đến tính chất vật lý và hóa học của phân tử vật liệu. So với các phân tử có kích thước micro thì các phân tử có kích thước nano có diện tích bề mặt riêng lớn hơn từ 1- 2 lần. Diện tích bề mặt riêng lớn cho phép phản ứng xảy ra ở nhiều điểm, đây là một tính chất làm cho hạt nano Fe0 phản ứng với các chất ô nhiễm với tốc độ cao hơn so với các vật liệu khác.
Từ tính của hạt nano Fe0
Từ tính của hạt nano Fe0 đóng vai trò quan trọng trong nhiều lĩnh vực như chất lỏng từ, các ứng dụng trong sinh y và chất xúc tác. Tuy nhiên trong lĩnh vực môi trường các nhà nghiên cứu lại có xu hướng muốn tránh đặc tính này. Do có diện tích bề mặt lớn và tính lưỡng cực, vật liệu nano Fe0 có xu hướng kết đám, hình thành những phân tử lớn hơn làm giảm diện tích tiếp xúc giữa phân tử nano và chất ô nhiễm và giảm sự vận chuyển các phân tử nano tại những điểm ô nhiễm. Vì vậy, trong lĩnh vực môi trường việc phân tán các hạt nano từ tính là một trong những yếu tố quan trọng để tăng hiệu quả của phản ứng này. Các nhà khoa học như He và Zhao (2010) đã sử dụng tinh bột để bọc hạt nano để chúng ít bị kết dính hơn và thu được kết quả khả quan. Ngoài ra một số nhà khoa học còn sử dụng chất phân tán hoặc khuấy cơ học để các phân tử nano không bị kết đám và vận chuyển tốt tại vị trí ô nhiễm. Nhờ những đặc tính đó hạt nano Fe0 có khả năng khử tốt hơn đối với các chất và hợp chất ô nhiễm so với các hạt Fe0 micro.
2. Các phương pháp điều chế nano Fe0
Một số phương pháp điều chế nano Fe0 như :
Phương pháp nghiền sử dụng kỹ thuật mài cơ khí thông thường để phá vỡ các hạt kim loại có kích thước lớn thành các hạt có kích thước micro hoặc là nano. Sự va chạm của các hạt hình cầu có thể phá vỡ kích thước của các hạt riêng biệt xuống còn vài nm và dẫn đến sự biến dạng bẻ gẫy và nối lại của chúng khi nghiền người ta thường sử dụng chất hoạt hoá bề mặt giúp cho quá trình nghiền được dễ dàng và đồng thời tránh các hạt kết tụ với nhau. Phương pháp nghiền có ưu điểm là đơn giản và chế tạo được vật liệu với khối lượng lớn. Nhược điểm của phương pháp này là tính đồng chất của các hạt nano không cao vì khó có thể khống chế quá trình hình thành hạt.
    |
 |
| Hình 3. Ảnh chụp SEM của sản phẩm nano Fe(0) tổng hợp được |
Polyol là phương pháp thường dùng để tạo các hạt nano kim loại như Ru, Pd, Au, Co, Ni, Fe,... Các hạt nano kim loại được hình thành trực tiếp từ dung dịch muối kim loại có chứa polyol. Polyol có tác dụng như một dung môi hoặc trong một số trường hợp như một chất khử ion kim loại. Dung dịch được điều khiển nhiệt độ để làm tăng giảm động học của quá trình kết tủa thu được các hạt có hình dạng và kích thước rất xác định. Hạt nano oxit sắt với đường kính 100nm có thể được hình thành bằng cách trộn tỷ lệ không cân đối hydroxide sắt với dung dịch hữu cơ. Muối Fe (II) và NaOH phản ứng với ethylene glycol (EG) hoặc polyethylene glycol (PEG) và kết tủa Fe xảy ra ở nhiệt độ từ 80-1000 C. Bằng phương pháp này còn có thể tạo các hạt hợp kim của Fe với Ni hoặc Co.
Cũng bằng phương pháp nhũ tương (microemulsion), người ta có thể chế tạo hạt oxit sắt bao phủ bởi một lớp vàng để tránh oxy hóa và tăng tính tương hợp sinh học.
Phương pháp đồng kết tủa là một trong những phương pháp thường được dùng để tạo các hạt oxit sắt. Hydroxide sắt bị oxy hóa một phần bằng một chất oxy hóa khác hoặc tạo hạt từ Fe2+ và Fe3+ trong dung môi nước. Kích thước hạt (4-15 nm) và điện tích bề mặt được điều khiển bằng độ pH và ion trong dung dịch.
Phương pháp hóa siêu âm là các phản ứng hóa học được hỗ trợ bởi sóng siêu âm cũng được dùng để tạo hạt nano oxit sắt. Hóa siêu âm là một chuyên ngành của hóa học, trong đó, các phản ứng hóa học xảy ra dưới tác dụng của sóng siêu âm như một dạng xúc tác. Sóng siêu âm là sóng dọc, là quá trình truyền sự co lại và giãn nở của chất lỏng. Tần số thường sử dụng trong các máy siêu âm là 20 kHz cao hơn ngưỡng nhận biết của tai người (từ vài Hz đến 16 kHz). Khi sóng siêu âm đi qua một chất lỏng, sự giãn nở do siêu âm gây ra áp suất âm trong chất lỏng kéo các phân tử chất lỏng ra xa nhau. Nếu cường độ siêu âm đủ mạnh thì sự giãn nở này sẽ tạo ra những lỗ hổng trong chất lỏng. Điều này xảy ra khi áp suất âm đó lớn hơn sức căng địa phương của chất lỏng. Sức căng cực đại này lại phụ thuộc vào từng chất lỏng và tạp chất ở trong đó. Thông thường, đây là một quá trình phát triển mầm; tức là, nó xuất hiện tại các điểm yếu tồn tại sẵn ở trong chất lỏng, như là những bọt khí hoặc những tiểu bọt khí tức thời có trong chất lỏng sinh ra từ những quá trình tạo lỗ hổng trước đó. Phần lớn các chất lỏng bị nhiễm bẩn bởi các hạt nhỏ mà lỗ hổng có thể xuất phát từ đó khi có mặt của áp suất âm. Một khi được hình thành, các bọt khí nhỏ bị chiếu siêu âm sẽ hấp thụ năng lượng từ sóng siêu âm và phát triển lên. Sự phát triển của các lỗ hổng phụ thuộc vào cường độ siêu âm. Khi cường độ siêu âm cao, các lỗ hổng nhỏ có thể phát triển rất nhanh. Sự giãn nở của các lỗ hổng đủ nhanh trong nửa đầu chu kì của một chu kì sóng siêu âm, nên đến nửa sau chu kì thì nó không có đủ thời gian để co lại nữa. Khi cường độ siêu âm thấp hơn, các lỗ hổng xuất hiện theo một quá trình chậm hơn gọi là khuyếch tán chỉnh lưu. Dưới các điều kiện này, kích thước của một lỗ hổng sẽ dao động theo các chu kì giãn nở và co lại. Trong khi dao động như thế lượng khí hoặc hơi khuyếch tán vào hoặc ra khỏi lỗ hổng phụ thuộc vào diện tích bề mặt. Diện tích bề mặt sẽ lớn hơn trong quá trình giãn nở và nhỏ hơn trong quá trình co lại. Do đó, sự phát triển của lỗ hổng trong quá trình giãn nở sẽ lớn hơn trong quá trình co lại. Sau nhiều chu kì siêu âm, lỗ hổng sẽ phát triển. Lỗ hổng có thể phát triển đến một kích thước tới hạn mà tại kích thước đó lỗ hổng có thể hấp thụ hiệu quả năng lượng của sóng siêu âm. Kích thước này gọi là kích thước cộng hưởng, nó phụ thuộc vào tần số của sóng âm. Ví dụ, với tần số 20 kHz, kích thước này khoảng 170 mm. Lúc này, lỗ hổng có thể phát triển rất nhanh trong một chu kì duy nhất của sóng siêu âm. Một khi lỗ hổng đã phát triển quá mức, ngay cả trong trường hợp cường độ siêu âm thấp hay cao, nó sẽ không thể hấp thụ năng lượng siêu âm một cách có hiệu quả được nữa. Và khi không có năng lượng tiếp ứng, lỗ hổng không thể tồn tại lâu được. Chất lỏng ở xung quanh sẽ đổ vào và lỗ hổng bị suy sụp. Sự suy sụp của lỗ hổng tạo ra một môi trường đặc biệt cho các phản ứng hoá học - các điểm nóng (hot spot). Hóa siêu âm được ứng dụng để chế tạo rất nhiều loại vật liệu nano như vật liệu nano xốp, nano dạng lồng, hạt nano, ống nano. Hạt nano oxit sắt và oxit sắt pha Co và Ni đã được chế tạo bằng phương pháp này. Tuy nhiên các hạt nano cần phải có chế độ xử lý nhiệt mới có thể đạt được từ độ bão hòa cao ở nhiệt độ phòng.
Hạt nano từ tính dựa trên oxit sắt đã được chế tạo bằng hóa siêu âm.
Đây là phương pháp rất đơn giản để tạo hạt nano từ tính với từ độ bão hòa rất cao.
Các nghiên cứu gần đây cho thấy các vật liệu nano chứa sắt có thể tổng hợp bằng phương pháp điện hóa bằng cách sử dụng anote sắt và catote titan trơ để điều chế sắt hạt nano. Dung dịch điện ly chứa 50g/l (NH4)2FeSO4, 20g/l muối trinatri axit citric, 10g/l axit citric và 40g/l axit boric. Nhiệt độ của bể phản ứng là 3030 K. Dòng điện với độ rộng xung ngắn được sử dụng để điều chỉnh kích thước hạt. Kết quả cho thấy hạt nano chế tạo có kích thước trung bình là 19nm và độ ổn nhiệt lên tới 5500 K.
Một phương pháp khác nữa là phân ly nhiệt. Sự phân ly của các hợp chất chứa sắt với sự có mặt của một chất hoạt hóa bề mặt ở nhiệt độ cao cải thiện đáng kể chất lượng của các hạt nano.
3. Một số ứng dụng trong xử lý ô nhiễm môi trường của nano Fe0
Do có đặc tính cho electron và khử nhiều chất ô nhiễm với tốc độ cao, nano Fe0 được sử dụng để xử lý nhiều chất ô nhiễm trong môi trường. So với hạt có kích thước micro, hạt sắt nano có tốc độ phản ứng lớn hơn do diện
tích bề mặt riêng và diện tích bề mặt hoạt động lớn hơn. Nano Fe0 có thể đi vào trong đất bị ô nhiễm, trầm tích và tầng ngậm nước. Các chất ô nhiễm mà nano Fe0 có thể xử lý bao gồm các hợp chất hữu cơ chứa clo, kim loại nặng và các chất vô cơ khác
a. Sự phân hủy các hợp chất hữu cơ chứa clo
Nano Fe 0 có thể khử hầu hết các hợp chất hữu cơ chứa clo như Poly Clorua Biphenyl (HCB), PolyChlorinated Biphenyl (PCB), diclodiphenyltricloetan (DDT), trichloroethene (TCE) thành các hợp chất hydrocacbon, clo và nước.
Yang – hsin Shih và cộng sự (2011) đã nghiên cứu cơ chế, động học và ảnh hưởng pH tới quá trình khử HCB bởi nano Fe0. Kết quả là 50% HCB được khử sau 24 giờ khi nồng độ nano Fe0 là 400g/l. Patanjali Varanasi và cộng sự (2007) đã nghiên cứu quá trình khử PCB bởi nano Fe0. Kết quả thu được là 38% PCB bị phá hủy trong mẫu đất đã trộn nano Fe0 tại nhiệt độ phòng. Theo các tác giả, tỷ lệ phá hủy thấp có thể là do sự khuếch tán thấp của PCB trong đất đến bề mặt chất xúc tác. Wei-xian Zhang là một trong những nhà khoa học đi đầu trong lĩnh vực nghiên cứu tổng hợp nano sắt và ứng dụng để xử lý các hợp chất clo hữu cơ như: TCE, PCBs, CCl4… Ông cũng đã thành công trong việc xử lý các dẫn xuất clo của etylen bằng nano sắt và xử lý các hợp chất clo hữu cơ bằng nano sắt phủ kim loại (Nguyễn Thị Nhung, Nguyễn Thị Kim Thường, 2007). Theo Wei-xian Zhang và cộng sự (2003), nano Fe0 được thử nghiệm để xử lý các hợp chất TCEs trong nước ngầm tại một căn cứ hải quân của Mỹ. Sau sáu tuần phun hạt nano Fe 0 xuống các giếng thử nghiệm, mẫu nước ngầm sau khi xử lý có nồng độ TCEs đạt tiêu chuẩn nước sạch. Nano Fe 0 có khả năng khử đối với các hợp chất hữu cơ chứa clo theo phương trình sau:
b. Loại bỏ các kim loại nặng
Loại bỏ asen
María E. Morgada và cộng sự (2009) đã tiến hành thí nghiệm ở các nồng độ nano Fe0 khác nhau (0,5; 2,5; 5; 7,5; 10g/l) để đánh giá khả năng hấp phụ As (III) (1mg/l ở pH =7) trên bề mặt vật liệu. Kết quả thu được cho thấy ngoại trừ ở nồng độ 0,5 g/l, hơn 80% lượng Asen bị hấp phụ trong 7 phút và gần 99% bị hấp phụ sau 60 phút. Dung lượng hấp phụ cực đại tính theo định luật Freundlich là 3,5mg Asen/g Fe0 nano ở 25o C. Xiaomin Dou và cộng sự (2010) đã nghiên cứu quá trình loại bỏ Asen khỏi nước bởi nano Fe0 và sự ảnh hưởng của các yếu tố như pH dung dịch, chất hữu cơ, anion vô cơ (photphat, cacbonat, silicat, nitrat, clorua, sunfat), axit humic.
Loại bỏ Crom và Chì
Trong nghiên cứu của J.Cao và W. Zhang (2006) đã cho thấy hiệu suất loại bỏ Cr (VI) rất cao khoảng 65 – 110mg Cr/g Fe0 nano. Cr (VI) bị khử xuống Cr (III), sau đó nó được kết hợp vào lớp vỏ oxit sắt (Crx Fe1-x)(OH)3 hoặc Crx Fe1-x(OOH). Theo nghiên cứu của Yunfei Xi và cộng sự (2010), nano Fe0 đã được tổng hợp và nghiên cứu khả năng khử Pb. Tại pH = 4 sau 15 phút tốc độ loại bỏ Pb đạt 99,9%. Hiệu suất của phản ứng là 0,05g nano Fe0 có thể loại bỏ > 99% Pb (401,8 mg/g). Ngoài ra nano Fe0 còn có khả năng loại bỏ Ni, theo đó Ni (II) bị khử xuống Ni(0). Hiệu suất khử là 0,13g Ni (II)/g Fe0 nano.
c. Sự loại bỏ các chất ô nhiễm vô cơ
Sự loại bỏ Selen
Mondal và cộng sự (2011) đã nghiên cứu loại bỏ Selen bằng nano Fe0. Trong thí nghiệm sau 5 giờ gần 100% Selen được loại bỏ hoàn toàn, sự loại bỏ Selen bởi nano Fe0 đạt 155 mg/g.
Sự loại bỏ Nitrat
Yu-Hoon Hwang và cộng sự (2011) đã nghiên cứu về cơ chế và các sản phẩm tạo ra của quá trình khử nitrat bởi nano Fe0. Kết quả nghiên cứu thu được là 97% nitrat được loại bỏ trong vòng 1 giờ và được loại bỏ hoàn toàn trong vòng 1,5 giờ. Số phận của các dạng nitơ đã được nghiên cứu và xác định, theo đó ammonia là sản phẩm chính của phản ứng khử nitrat bởi nano Fe0 và nó bị loại bỏ khỏi dung dịch tại pH cao.
Sự loại bỏ ion Phốt phát
Theo Nguyễn Xuân Huân & Lê Đức (2015), Talal Almeelbi & Achintya Bezbaruah (2011), khi pH thấp dung dịch có H+ tự do, các hạt nano Fe0 ở bề mặt ngoài hạt nano dễ dàng chuyển thành Fe(II), Fe(III) và trở thành vật liệu hấp phụ photphat. Hơn thế nữa khi pH thấp thì vật liệu Fe0 nano có điện tích bề mặt dương (+) nên nó có khả năng hấp phụ với PO43- tốt hơn. Khi pH tăng, H+ trong dung dịch giảm làm cho hiệu quả xử lý cũng giảm. Trong điều kiện pH khác nhau photphat bị hấp phụ bởi nano Fe0 ở pH thấp là thuận lợi hơn. Còn trong điều kiện pH cao thì giải hấp là hiện tượng chiếm ưu thế.
    |
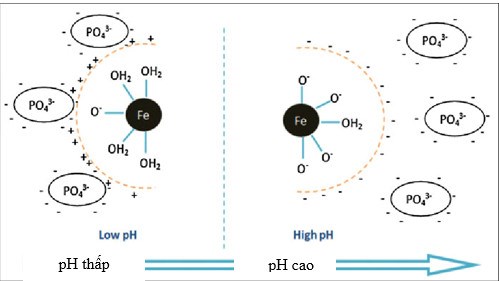 |
| Hình 4. Khả năng hấp phụ photphat bởi vật liệu nano Fe0 ở pH khác nhau theo Talal Almeelbi & Achintya Bezbaruah (2011) |
Hình 4. Khả năng hấp phụ photphat bởi vật liệu nano Fe0 ở pH khác nhau theo Talal Almeelbi & Achintya Bezbaruah (2011)
Đây là nghiên cứu tổng quan năm 2025 của tác giả TS. Nguyễn Thị Hiển thuộc Nhóm nghiên cứu mạnh Công nghệ sinh học Môi trường và Nông nghiệp.
Nhóm nghiên cứu xin trân trọng cảm ơn Học viện Nông nghiệp Việt Nam đã hỗ trợ kinh phí, tạo điều kiện để nhóm NCM thực hiện và hoàn thành bài tổng quan này.
Tài liệu tham khảo
1. Nguyễn Xuân Huân, Lê Đức (2015). Phương pháp chế tạo vật liệu Fe0 nano có thể bảo quản ở điều kiện thường và ứng dụng để kết hợp xử lý nitrat và phosphate trong nước, Kỷ yếu hội thảo khoa học quốc gia lần thứ III: "Môi trường và phát triển bền vững trong bối cảnh biến đổi khí hậu"/Hà Nội ngày 13 tháng 11 năm 2015, NXB Khoa học Tự nhiên và Công nghệ.
2. Nguyễn Thị Nhung, Nguyễn Thị Kim Thường (2007). Nghiên cứu tổng hợp Nano sắt bằng phương pháp hóa học, Tạp chí Khoa học Đại học Quốc gia Hà Nội, Khoa học Tự nhiên và Công nghệ 23, tr. 253-256.
3. Amal Kumar Mondal, Sanjukta Mondal (Parui)*, Sumana Samanta and Sudebi Mallick (2011). Synthesis of Ecofriendly Silver Nanoparticle from Plant Latex used as an Important Taxonomic Tool for Phylogenetic Interrelationship, Advances in bioresearch, vol. 2 [1], pp. 122 – 133.
4. Chul C.H., Mohammad A.B., Raj S. (2008). Method of sunthesing air-stable zerovalent iron nanoparticles at room temperature and application, United States Patent Application 2008/009105.
5. Heesu Park, Yong-Min Park, Kyoung-Min Yoo and Sang-Hyup Lee (2009). Reduction of nitrate by resin-supported nanoscale zero-valent iron, Water Science & Technology—WST, Vol 59, No 11, pp. 2153–2157.
6. María E. Morgada, Ivana K. Levy, Vanesa Salomone, Silvia S. Farías, Gerardo López, Marta I. Litter (2009). Effects of hardness and alkalinity on the removal of arsenic(V) from humic acid-deficient and humic acid-rich groundwater by zero-valent iron, Water Research, Volume: 43, Issue: 17, Publisher: Elsevier Ltd, Pages: 4296-4304.
7. Patanjali Varanasi, Andres Fullana, Sukh Sidhu (2007). “Remediation of PCB contaminated soils using iron nano-particles”, Chemosphere 66, pp. 1031-1038.
8. Talal Almeelbi, Achintya Bezbaruah (2011). “ Aqueous photphate removal using nanoscale zero-valent iron”. Springer Science + Business Media B.V.2012.
9. Wei-xian Zhang (2003). “ Nanoscale iron particles for environmental remediation:An overview ”, Journal of Nanoparticle Research 5: 323–332.
10. Xiaomin Dou, Rui Li, Bei Zhao, Wenyan Liang (2010). Arsenate removal from water by zero-valent iron/activated carbon galvanic couples”. Journal of Hazardous Materials 182, pp. 108–114.
11. Yu-Hoon Hwang, Do-Gun Kim, Hang-Sik Shin (2011). Mechanism study ofnitrate reduction by nano zero valent iron”, Journal of Hazardous Materials 185, pp. 1513–1521.
12. Yunfei Xi, Megharaj Mallavarapu, Ravendra Naidu (2010). Reduction and adsorption of Pb2+ in aqueous solution by nano-zero-valent iron-A SEM, TEM and XPS study, Materials Research Bulletin 45, pp. 1361–1367.
TS. Nguyễn Thị Hiển – Bộ môn Hóa học
Khoa Tài nguyên và Môi trường
Nhóm nghiên cứu mạnh Công nghệ sinh học Môi trường và nông nghiệp